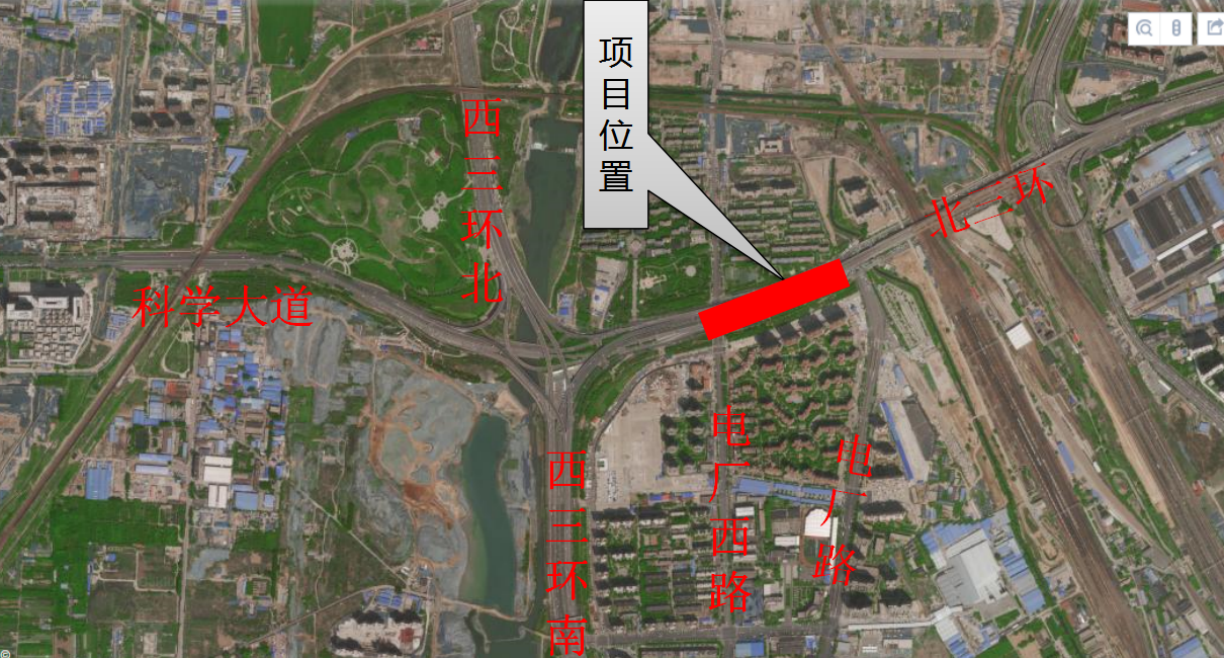
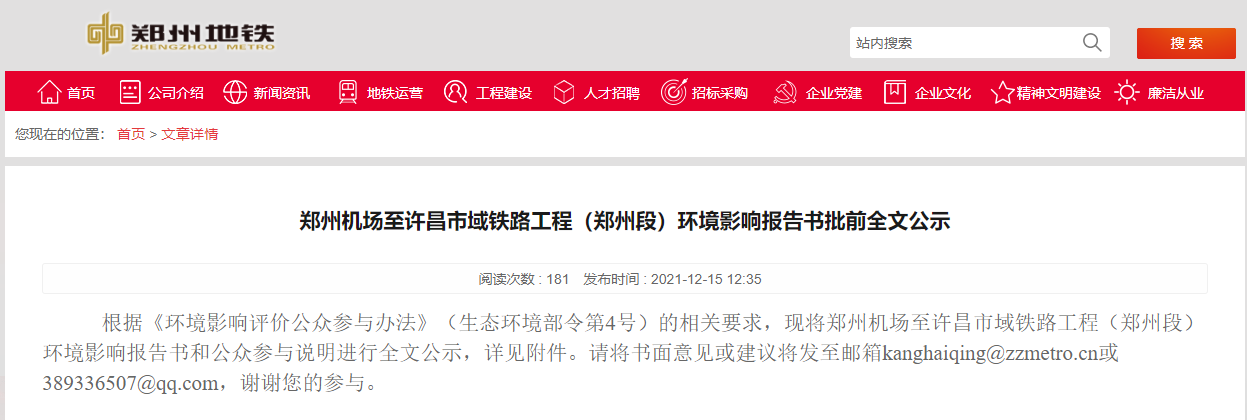
日前,中国国家药品监督管理局正式批准了罗氏旗下重磅神经创新药物艾满欣(利司扑兰口服溶液用散)用于治疗2月龄及以上患者的脊髓性肌萎缩症(SMA)。这是首个在中国获批治疗SMA的口服疾病修正治疗药物,将为中国的SMA患者和家庭提供全新的治疗选择。
SMA的主要发病原因是由于患者SMN1基因的缺失或突变,导致全身功能性SMN蛋白表达不足,进而影响患者的运动、呼吸、吞咽以及脾脏、心脏、胰腺等多器官,甚至威胁生存。SMA是导致婴儿死亡的最常见遗传疾病之一。重症SMA患儿如不进行有效治疗,80%患儿会在一岁内死亡,很少能存活超过两岁。
SMA的发病率为存活新生儿中1/10000,每年国内约新增1000例SMA患者,其中约80%患者在出生后18个月内起病。2018年5月,国家卫生健康委员会等五部门联合制定的《第一批罕见病目录》,旨在进一步加强罕见病管理,提高罕见病诊疗水平。SMA被列入第一批纳入目录的121种罕见病之一。
中华医学会儿科分会内分泌遗传代谢学组副组长熊晖教授表示,SMA患者越早诊断,越早开始有效治疗,预后越好,甚至在症状前开始治疗,有希望达到同龄非患病儿童的状态。SMA会造成患者多系统的异常,在治疗时要关注患者运动、呼吸、吞咽及其他系统。所以在临床上,SMA的治疗也非常需要多学科团队共同协作参与。
SMA患者,用利司扑兰口服溶液用散后运动功能及生活独立性获得改善。2020年4月,罗氏向国家药品监督管理局递交利司扑兰上市申请,6月利司扑兰获得优先审评资格认定。目前,利司扑兰已在包括中国在内的超过40个国家及地区获批,且在全球范围内,已有超过3000位SMA患者接受利司扑兰治疗。
“利司扑兰的获批是国内SMA治疗史上的一个重要里程碑,意味着SMA的治疗进入了口服治疗的新阶段,中国SMA患者和家庭迎来了新的希望。”中华医学会儿科分会罕见病学组组长、复旦大学附属儿科医院主任医师王艺教授表示。
中华医学会儿科分会副主任委员、神经学组组长姜玉武教授表示:“利司扑兰的获批,为国内SMA患者和家庭带来了新选择,同时也将进一步推动国内SMA的临床规范诊疗。最近几年,我国SMA的临床诊疗发展迅速,目前国内已成立了一批具有多学科诊疗能力和经验的SMA诊治中心。随着更多有效治疗药物的可及,SMA的规范化诊疗和疾病的长程管理也将逐渐完善,SMA治疗的中国经验将进一步丰富,为SMA患者和家庭带来全面获益。”(记者 左妍)
-
深圳一男子加油站拔油枪点燃后逃跑 警方已介入调查纵火人员已锁定
头条 21-12-17
-
这位感动千万抖音网友的河南“留虾女孩” 入选央视年度短片《2021看见笑容》
头条 21-12-17
-
泪目!95岁妈妈病床前亲吻74岁生病的女儿 网友:孩子不管多大都是妈妈的宝贝
头条 21-12-15
-
川妹子抽中50颗榴莲直呼吃不完!网友:可以共享你的负担吗?
头条 21-12-15
-
河南省政府发布2022年元旦放假通知
头条 21-12-15
-
濮阳市聚碳新材料产业联盟成立
头条 21-12-15
-
周口机场预计什么时候建好?都有到哪些城市的航线?官方回复来了
头条 21-12-15
-
预计明年超50家企业回归,瑞银称中概股H股上市将继续升温
头条 21-12-15
-
新乡发现一境外输入奥密克戎病例密接者,活动轨迹公布
头条 21-12-15
-
河南:中药配方颗粒不得在医疗机构以外销售
头条 21-12-15
-
中原环保完成发行5亿元超短融,利率2.95%
头条 21-12-15
-
南阳市政府将与中车四方所在新能源装备等领域开展深入合作
头条 21-12-15
-
郑州出台新措施:公租房可“掌上”缴租秒办理
头条 21-12-15
-
国家统计局:11月社会消费品零售总额增长3.9%
头条 21-12-15
-
中国11月规上工业增加值同比增长3.8%
头条 21-12-15
-
1207万!全年就业超额完成预期目标
头条 21-12-15
-
河南凯旺科技公开发行2396万股新股,获6321.47倍申购
头条 21-12-15
-
事关货币政策、房地产、全面注册制,一行两会划定明年工作重点
头条 21-12-15
-
隔夜欧美·12月15日
头条 21-12-15
-
多部委密集部署明年工作!三大看点值得关注
头条 21-12-15
-
立方风控鸟·早报(12月15日)
头条 21-12-15
-
医药巨头今日登陆科创板!高瓴重仓"陪伴",引入"绿鞋"机制
头条 21-12-15
-
皮海洲:临门一脚踏刹车!龙竹科技终止转板说明了什么
头条 21-12-15
-
立方风控鸟·晚报(12月14日)
头条 21-12-14
-
成渝地区双城经济圈建设2022年拟推进160个重大项目,投资约2万亿元
头条 21-12-14
-
总投资额超百亿!中建七局接连中标两个EPC总承包项目
头条 21-12-14
-
2022年部分地方债提前下达,财政提前发力稳经济
头条 21-12-14
-
信阳华信投资集团10亿元中票完成发行,利率3.70%
头条 21-12-14
-
新强联拟择机出售所持明阳智能股票
头条 21-12-14
-
洛阳新强联拟亿元入股山东拟IPO公司,持股4.50%
头条 21-12-14
-
焦作在这场推介会上现场签约28个项目,总投资240亿元
头条 21-12-14
-
河南7种轻微交通违法可免罚
头条 21-12-14
-
广州高校发现古墓考古专业出动!网友:这不巧了嘛!毕业论文自己找来了
头条 21-12-14
-
浙江乐清民警自曝37岁未婚救下轻生女子 网友:一定要最爱自己
头条 21-12-14
-
画面感太强!主人出差猫咪打开水龙头把家淹了 网友:当然是原谅它
头条 21-12-09
-
8岁双胞胎姐妹玩捉迷藏捡到20万摆地摊妈妈报警找失主 网友纷纷点赞
头条 21-12-08
-
女子9楼坠落紧紧抓住7楼防护窗所幸有惊无险!网友:不幸中的万幸啊
头条 21-12-07
-
江西一年级萌娃穿航天服走方阵 网友:可可爱爱的小小航天员
头条 21-12-06
-
女子精心养了半年的盆栽竟是塑料做的 网友:这是做的有多真
头条 21-11-30
-
河南郑州一女子怀上八胞胎!医生一句话说出罕见原因 全家又喜又忧
头条 21-11-26
-
央视新闻AI手语主播正式亮相!网友:专业!第一反应就想到了朱广权
头条 21-11-25
-
网信办:严防违法失德艺人“曲线复出” 营造积极健康向上的网络环境
头条 21-11-24
-
神奇!女子用砂锅煮绿豆粥自动吐皮 网友:这个锅好“懂事”
头条 21-11-23
-
湖南一怀孕老师晕倒学生们立刻化身“闪电侠”飞奔相救
头条 21-11-23
-
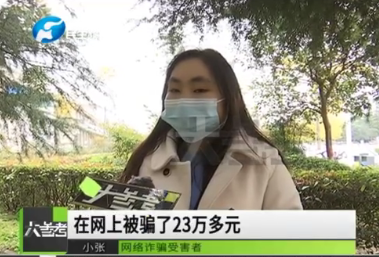
26岁癌症女孩刷单被骗23万救命钱 想挣外快结果救命钱打了水漂
头条 21-11-23
-
河南郑州六旬白发教授夜访男寝教微积分:都追到宿舍再学不会就对不起老师
头条 21-11-19
-
男子捡枪上交进门瞬间吓坏警察迅速拔枪警戒 网友:进门倒是说一声啊
头条 21-11-19
-
硬核!男子酒后执意开车被兄弟卸掉轮胎 网友:这才是真朋友啊!
头条 21-11-18
-
撒贝宁时隔4年回归主持今日说法 网友激动喊话:“爷青回”
头条 21-11-18
-
广州一流浪猫被五星级酒店收留凭实力找到长期饭票 每天吃米其林星级员工餐
头条 21-11-17
-
考研冲刺倒计时大学生拿灯管学习?消防员蜀黍顺着网线找来了!
头条 21-11-16
-
经商奇才!长春女子为南方人雪地代写6天赚300元 网友:雪起码得分三成
头条 21-11-16
-
实用又好看!陕西渭南村民在院墙上栽满仙人掌防盗 网友:真的很好看~
头条 21-11-15
-
果农“为国家做研究”捐橘子 网店老板找到了!老板:大家理性消费
头条 21-11-15
-
大乌龙!星空灯下男子捧花告白跪错人 网友:社死现场!
头条 21-11-15
- 《南京市中小学生营养午餐指南》(2021版)2021-12-20
- “十四五”我国将大力提高技工待遇 推动高2021-12-20
- 修订后的《高等学校思想政治理论课建设标准2021-12-20
- 内地奥运健儿与澳门青少年运动员开展对话交2021-12-20
- 香港中联办声明:祝贺香港特区第七届立法会2021-12-20
- 今日起 石家庄市区小学生和幼儿上下学免费2021-12-20
- 江西南昌杀妻抛尸案二审维持死刑:被告人主2021-12-20
- 山东通报关于艺考考生违规携带手机网传试卷2021-12-20
- 战鼓催征练兵急——第81集团军某旅学习十九2021-12-20
- “十四五”县域普通高中发展提升行动计划 2021-12-20
- 《全国普通高校本科教育教学质量报告(20202021-12-20
- “中小学教师的负担也要真的减下来” 教师2021-12-20
- 郑济高铁郑濮段首个动力“心脏”送电 其他2021-12-20
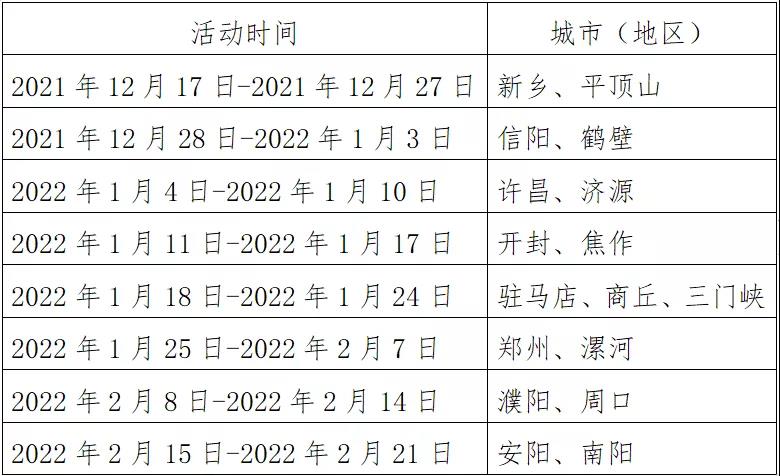
- 河南印发紧急通知 即日起至明年2月底开展2021-12-20
- 降温!暴雪!本周河南气温将出现今年入冬以2021-12-20
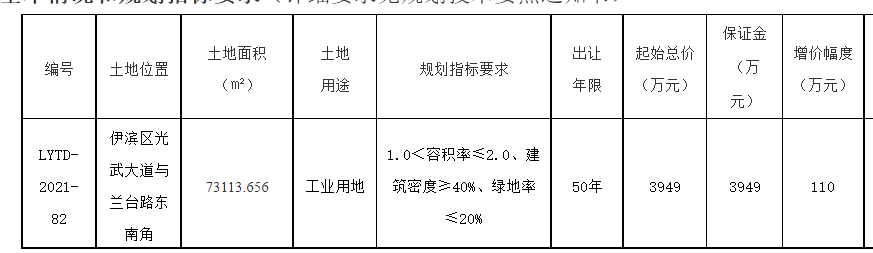
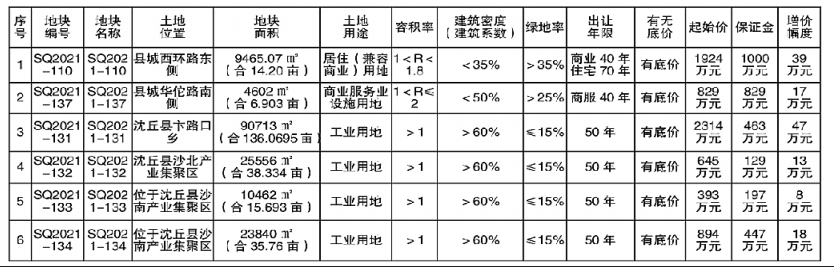
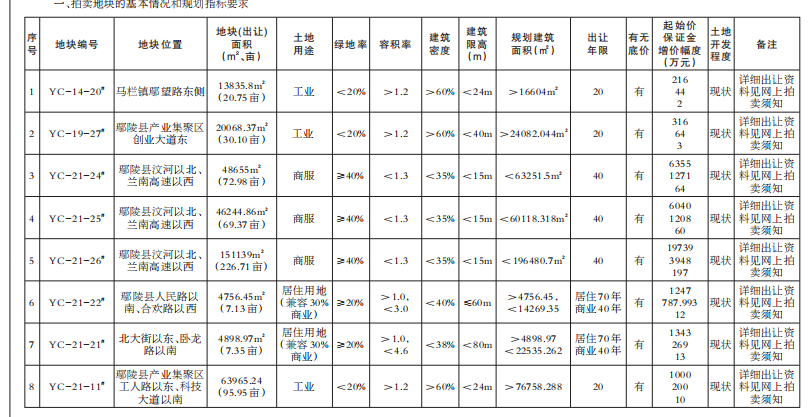
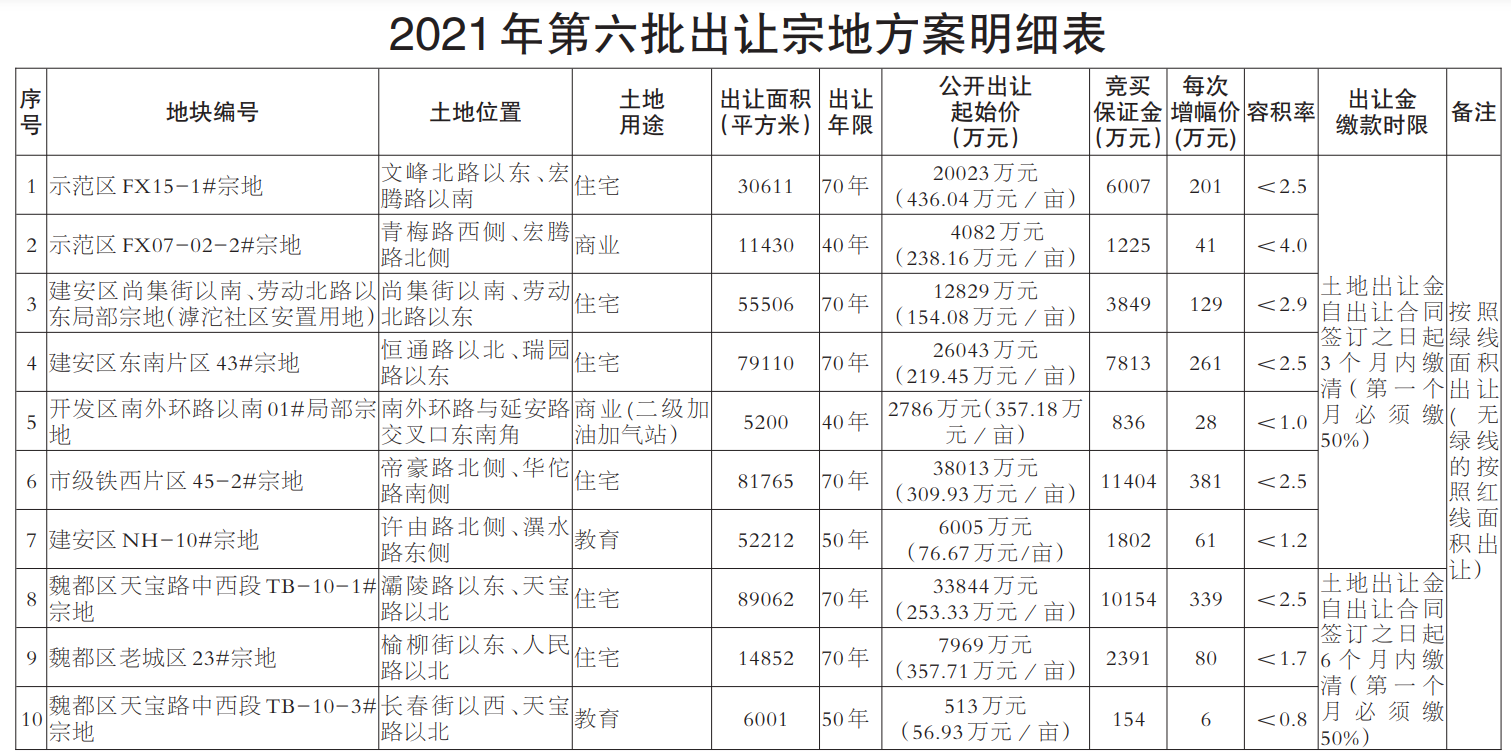
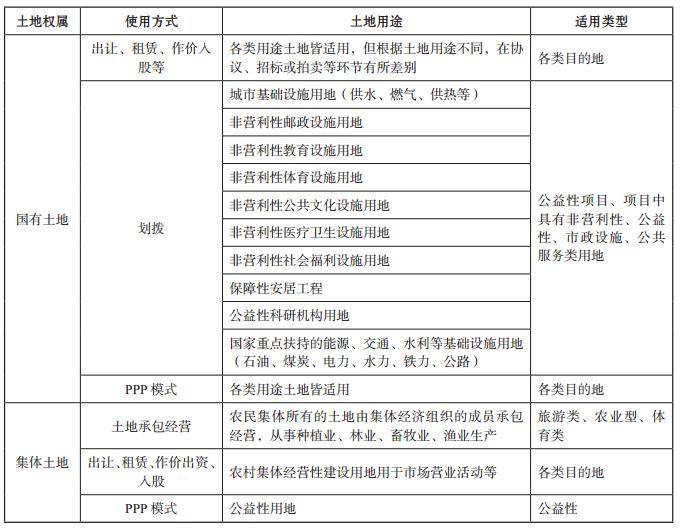
- 绿维文旅:土地开发与运营要点2021-12-20
- 颠覆级豪华改装登场,风行M7领爵款演绎豪华2021-12-20
- 借力清华大学课题研究 顾家家居与高校年轻2021-12-20
- 14万起售即豪华,进阶MPV世家焕新力作东风2021-12-20
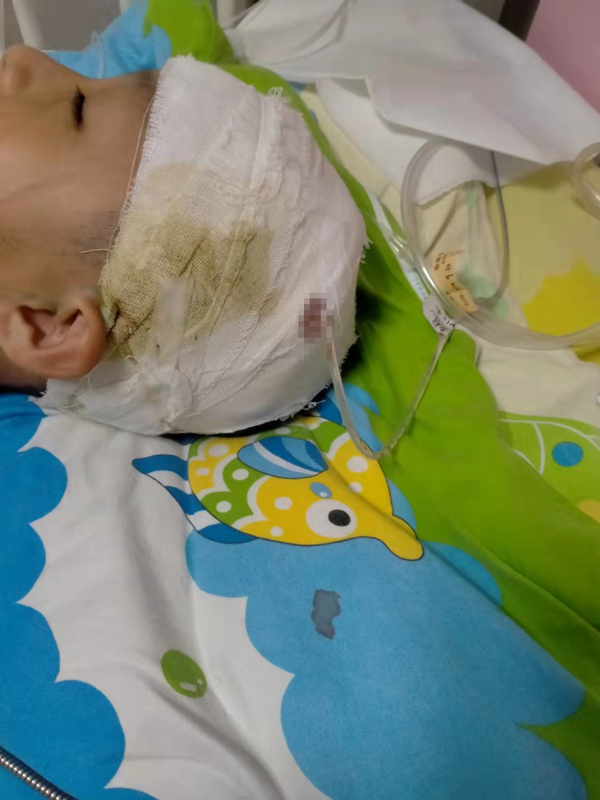
- 周口小学生被校长拍打头部后病发 校长是否2021-12-20
- 太揪心!山西孝义透水事故获救人员讲述被困2021-12-20
- 国家卫健委:昨日新增本土确诊病例37例,其2021-12-20
- 浙江省新增确诊病例12例,其中杭州市1例、2021-12-20
- 浙江昨日新增本土确诊病例10例 境外输入确2021-12-20
- 内蒙古昨日新增境外输入确诊病例7例2021-12-20
- 香港特区政府新闻公报:行政长官林郑月娥将2021-12-20
- 河南高纯石英砂提纯技术获突破 提纯二氧化2021-12-20
- 郑州一年内新增易货公司100多家 靠收服务2021-12-20
- 出山店水库移民安置工作通过国家验收 历时2021-12-20
- 鹤壁辛村遗址发现殷遗民贵族墓葬2021-12-20