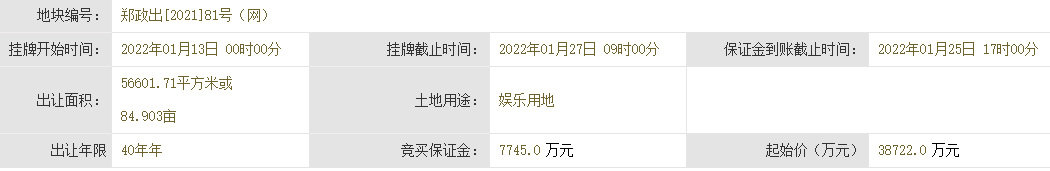
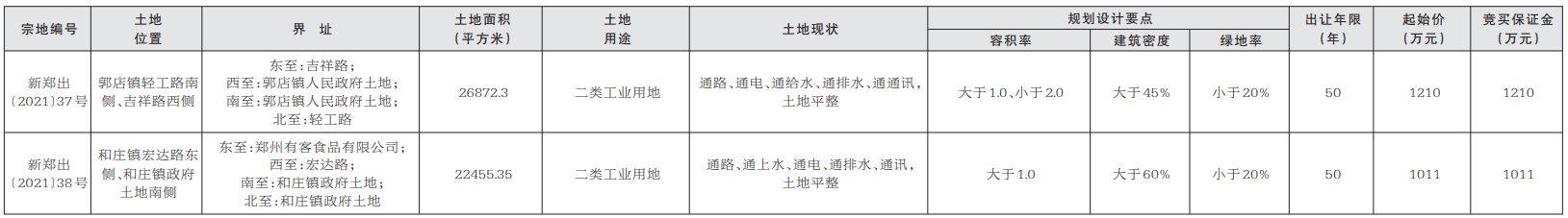
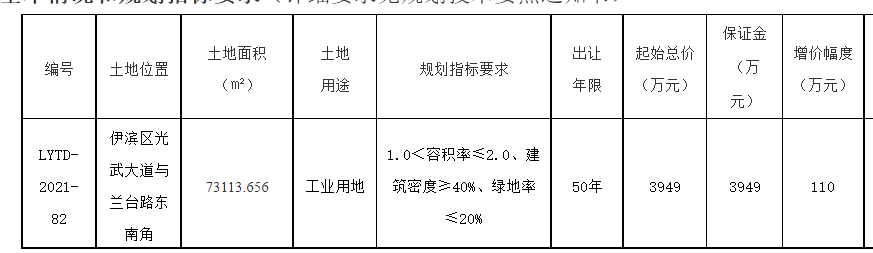
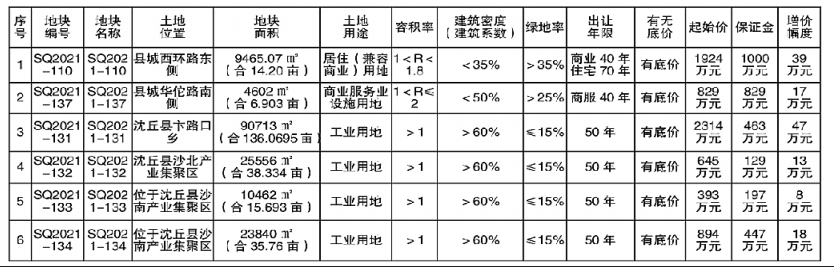
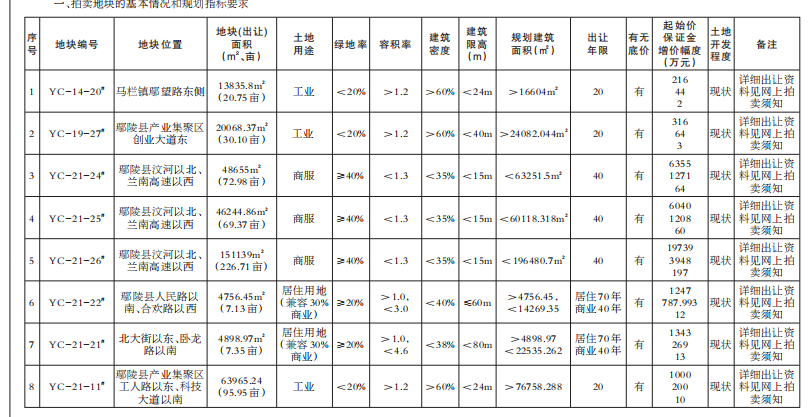
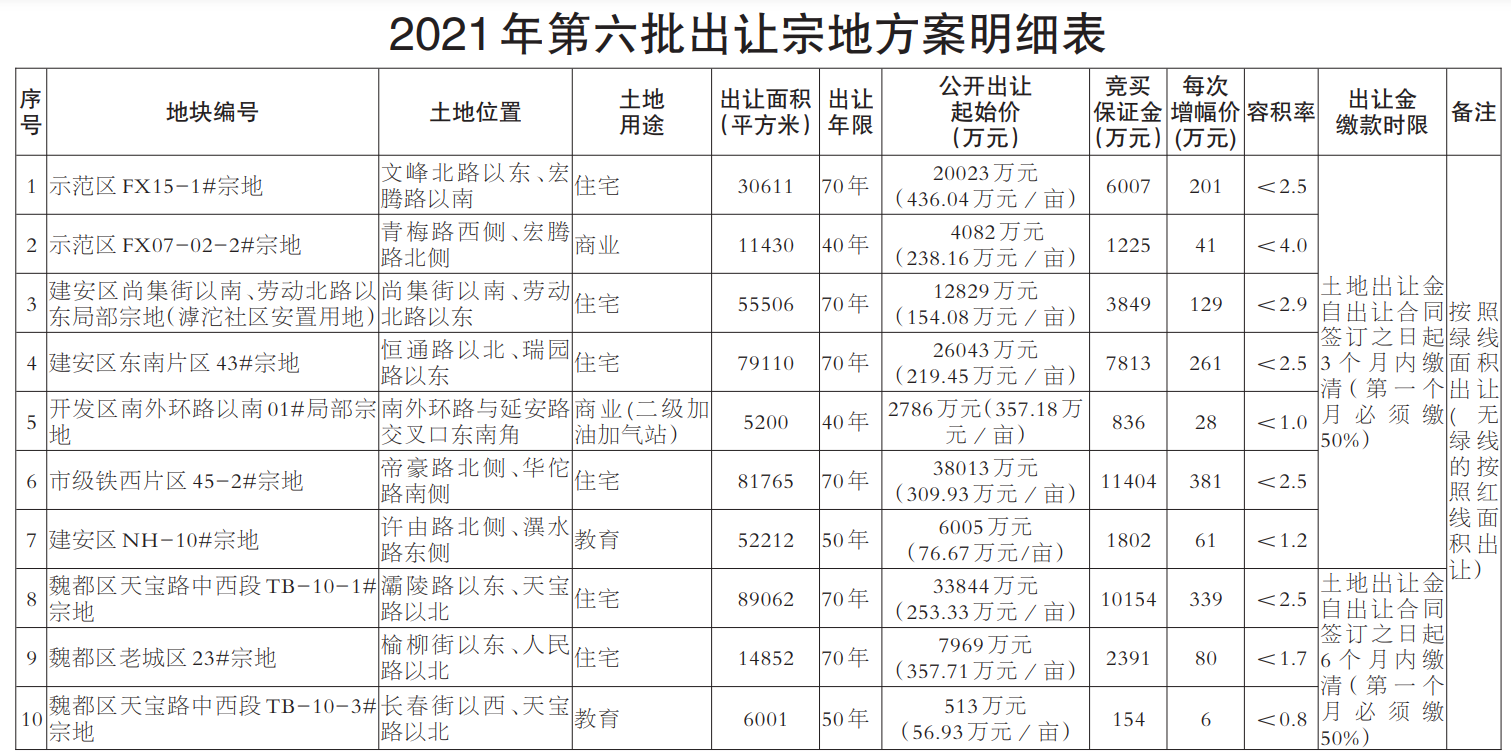
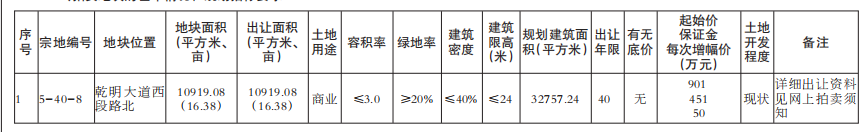
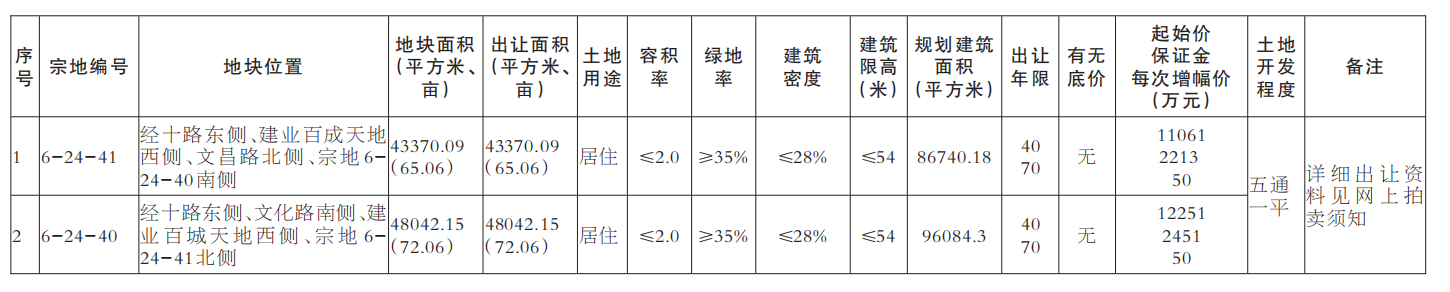
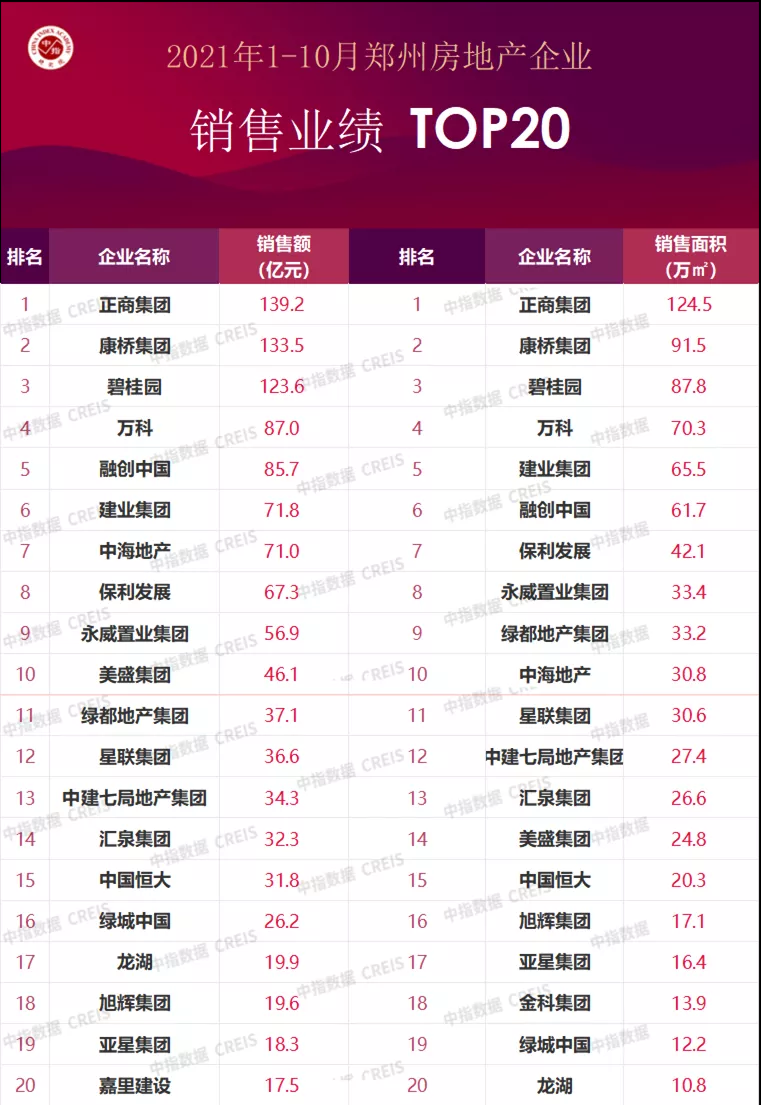
基因突变的演化树不仅能揭示不同组织中致癌细胞的相互关联性,还能揭示癌症的演化历史。在癌症早期,某些致癌基因发生突变,似乎是导致原发性肿瘤以及转移性肿瘤的罪魁祸首。针对早期发生突变的致癌基因研发的药物,有可能成为癌症治疗(原发性肿瘤形成早期和癌症末期)的关键。
未来,通过构建患者个人的基因突变演化树,我们很可能会找到治疗耐药性癌症的策略。
1.生命之树
长久以来,生物学家通过研究基因来了解“生命树”的生长史。生命树将地球上的所有生物联系起来——无论它们是狨(一种世界上体型最小的猴)还是微生物。我们所属的“智人”就是这棵枝叶繁茂的演化树上的一张叶片,在它旁边的那些叶片则是各种类人猿。而人类的每一个个体又是由各种人体细胞构成的一个集合。

创意图片《癌症演化树》
一般来说,这些细胞都共同遵守一个契约。在大约6亿年前出现的第一批多细胞生物中,这一契约就已在反复试错的基础上建立起来了。按照这个契约,如果多个细胞要在一起共生,就必须遵守以下基本准则:当细胞中的DNA受损时须及时进行修复;细胞是否继续进行分裂繁殖须顾及相邻细胞的意愿;细胞须待在相应组织的特定位置。
通常情况下,那些导致细胞违反这些限制,开始不断生长、扩散(恶性肿瘤细胞的标志)的基因突变,可以通过细胞凋亡来消除。发生突变的细胞在发现自身问题后,会启动自毁机制或在对身体造成危害前被免疫系统消灭。
然而在少数情况下,监测系统失灵,细胞中的基因突变不断累积,肿瘤就会生长扩散。一棵恶性演化树就此生根发芽。
研究人员已经知道,一些基因突变对肿瘤的发生(即原始肿瘤的形成)起着推动作用。然而,真正致命的却是癌细胞的转移性(即癌变细胞从原发性肿瘤中逸出,侵入健康组织,并在那里产生新的肿瘤)。由于肿瘤学家认为,只有在细胞发生了进一步基因突变后,才会产生转移性肿瘤,而且这些突变发生在原发性肿瘤发展阶段的晚期,所以他们通常致力于寻找这些基因突变,将其作为抗癌药物的作用对象。
2010年左右,由于技术的进步,科学家能够以低廉的价格对人类基因组进行测序——即推断基因组的碱基(DNA的基本组成单位)序列。于是,多个研究机构的研究小组开始对肿瘤的基因序列进行全面研究。令人沮丧的是,研究人员发现,即使在同一个病人体内,肿瘤所包含的基因变异也多得让人眼花缭乱。
然而,像我这样的演化生物学家却将多样性视为宝贵的信息来源。我决定与耶鲁大学及其他研究机构的同事一起,对这些基因突变之间的关联性进行研究。我们对癌症病人基因组中表达的那部分(已知的、控制蛋白质表达并由此决定细胞特性的那部分DNA片段)进行了测序。我们还进一步利用这些信息,建立了与疾病相关的基因突变演化树。该演化树的分支向我们展示了,随着癌症从初始的几个肿瘤细胞发展成具有转移性的怪物,肿瘤内部的基因在这一过程中是如何发生变化的。
2.神秘毒树
我们的研究显示,那些将原发性肿瘤与转移性肿瘤联系在一起的枝干,在病人的癌症树中似乎大量地随机出现,就像一棵神秘的毒树的树枝。更令人惊讶的是,演化树的第一批分支可以出现在原始肿瘤内部。原发性肿瘤内的不同细胞,可能在初始肿瘤得到确诊的多年前,就演化成更具侵略性的形式,而且发生扩散的遗传机制也各不相同。
虽然这些发现很是骇人,但也给我们带来了希望。这提醒癌症研究人员,与其专注于晚期突变,不如更关注原发性肿瘤(癌症树的起源)中的早期基因突变。针对后者研发药物,或许将增加癌症病人康复的概率。
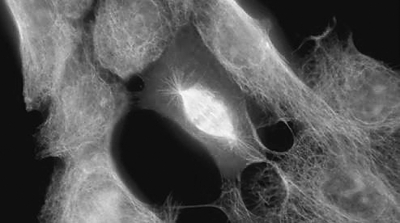
偏光显微镜下的转移性肝癌细胞
数十年来,科学家一直使用一个线性模型来指导癌症研究。根据该模型,肿瘤的产生是由一系列特定基因的突变导致的。只有这些基因突变发生后,原发性肿瘤内部的一些细胞才会进一步发生一个或多个突变,获得转移的能力。如果我们能针对这些基因突变构建一棵演化树,那么这棵树的形状将有点像草:又高又直,只有一根主干,叶片和种子生长在主干上接近顶部的位置。
该理论与演化生物学家深谙的生物演化史并不相同。不间断的基因突变与选择,促使生物物种出现分化,产生尽可能多样的遗传品系,而非单一的均质种群。实际上,英国伦敦癌症研究所的马可·格尔林根及其他研究者的早期研究显示,即使在原发性肿瘤中,不同区域的肿瘤细胞都具有不同的基因序列。
2010年,我与我的实验室成员(作者在美国耶鲁大学公共卫生学院),及耶鲁大学医学院的病理学家戴维·里姆、遗传学家理查德·利夫顿和药物学家约瑟夫·施勒辛格一起,致力于回答在研究过程中发现的3个问题。第一,癌症的转移是否需要一个或多个特定的基因突变,这些突变是否出现在所有病人中?第二,能否在多数基因突变累积起来之前,在原发性肿瘤发生的相对早期阶段,就将转移性品系从中分离出来?第三,如果在原发性肿瘤和转移性肿瘤中发现多种突变,我们能否利用演化树来估计突变发生的时间?回答出这些问题,我们就可以描绘出导致原发性肿瘤产生以及引起肿瘤转移的遗传轨迹。
3.毒树之果
当时,我们并不知道,我们的演化学工具将会发挥多大的作用。里姆从40位死于13种癌症的患者的原发性肿瘤、继发性肿瘤及相邻健康组织中提取了样本。对于每一份样本的基因组,只要是我们知道的在任何组织、任何时间表达过的基因片段,我们都会测定它的序列。我们在一个或多个癌变组织中,发现了数十至数千种异于病人体内正常基因序列(即生殖细胞系的序列,来自于最初的受精卵)的基因突变。
为了了解这些样本之间的关联性,我们实验室的博士后研究员赵子铭(音译,Zi-MingZhao)为它们构建了分子演化树。这种树状图原本是用来厘清人类与黑猩猩、大猩猩及红毛猩猩之间的亲缘关系,以及猿与其他哺乳动物、哺乳动物与鸟类及其他动物、动物与真菌、植物和细菌之间的关系。科学家通过比较这些物种在生物性状(或其DNA序列)上的差异,将它们放置在演化树上的不同位置。
然而,将这些技术应用于癌症并不简单。通常,我们仅使用现有物种的基因序列来推测其祖先的相关信息。而在癌症演化树中,我们知道癌细胞祖先的基因序列:它是从健康组织中获得的生殖细胞系序列。如果不做任何改变,按照传统的做法,应该把正常序列看作是一个“后代”种系,那么由此构建的演化树将不会反映我们所感兴趣的历史。于是,我们对这一经典方法做了一些改变,将健康组织的基因序列作为原发性和转移性肿瘤细胞系的祖先,并据此构建出最可能解释这一系列变化的演化树。
重新调整过的演化树给我们带来了一些惊人发现。根据存在已久的线性模型,所有的转移性肿瘤细胞都源自一个从原发性肿瘤中逸出,并扩散到其他部位的细胞系。如果转移性肿瘤确实是这样形成(即源自一系列DNA突变的最后一个突变)的,那么,与原发性肿瘤的基因序列相比,继发性肿瘤的基因序列应该与其他继发性肿瘤更接近。
但我们观察到的事实却并非如此。当我们开始研究癌症演化树时,我们发现,有些病人的原发性肿瘤与一些转移性肿瘤的亲缘关系较近,而与另一些转移性肿瘤的亲缘关系却较远。这一发现表明,在某一时间,原发性肿瘤内部变成转移性肿瘤的细胞系有多个而非一个。实际上,在我们构建的高分辨率的演化树中,这种模式出现的概率超过了1/3。
4.演化树与时间树
经典的线性模型与实际数据不符,这让我们感到很惊讶。我们的证据显示,诱发癌症转移的并非单一的罕发事件,早期发生的、导致肿瘤增殖的基因突变,也会提升肿瘤细胞系的转移能力。
而且,对那些变成转移性肿瘤的细胞系,我们无法将其转移性归因于任何单一的基因突变。除了那些已知的驱动肿瘤产生的主要基因(例如,几乎在所有胰腺癌病人的原发性肿瘤中,KRAS基因都发生了突变),多名病人的转移性肿瘤中并没有发生特定的基因突变。实际上,在那些指向继发性肿瘤的分支中发现的基因变异,与那些从未离开过原发性肿瘤的细胞系中的基因变异,并没有显著不同。在原发性肿瘤细胞中,基因突变之外的其他因素(如表观遗传变化,即DNA序列不发生变化但基因表达却发生了可遗传的改变),或细胞的微环境发生了变化,更有可能导致癌症转移。
原发性肿瘤细胞中发生的表观遗传修饰(例如偶然接触致癌物质导致的变化),可能增加细胞发生转移的概率。细胞所处的位置也会影响它们的转移性。例如,一些肿瘤细胞可能因为正好接近血管或淋巴管,就更容易扩散到全身,而其他具有相同基因突变的肿瘤细胞,则可能由于所处位置离血管或淋巴管较远,而不容易发生扩散。这些可能影响肿瘤转移的因素,或许与后期出现在我们的癌症演化树上的基因突变关系不大。
搞清楚原发性肿瘤有时会产生不同的转移性肿瘤后,接下来我们想知道,到底早在什么时候,这些转移性的肿瘤细胞系就开始出现差异了。我们的分子演化树无法回答这个问题:这些分支的长短对应的并非实际时间,而是用以区分癌症各部分(如原发性肿瘤和转移性肿瘤)的基因突变的数量。所以,演化树不会告诉我们,一个肿瘤产生新的肿瘤所需的时间长短。
于是我们就想,是否可以使用演化生物学的另一项技术——时间树,来了解人体内癌症的发展过程。不同于分子演化树,时间树中的分支长度对应着一个生物物种演化形成另一物种所耗费的时间。构建时间树的原理是,先对比相关特性(如基因序列),然后将这些特征与时间信息(如突变率)联系起来,进而让科学家可以推测重要突变发生的时间。这种技术已用于化石数据的分析,比如,确定“寒武纪生命大爆发”(Cambrianexplosion,指5.5亿年前各种多细胞生物突然大量出现)的发生时间。
虽然我们没有化石来校正个体一生中癌症的演化过程,但我们却拥有更好的研究材料。在很多情况下,我们拥有尸检之前的各种原始组织。我们还有每个病例的医疗记录,能提供病人出生、诊断、活检、肿瘤取出以及尸检的日期,而这些日期则可以作为时间校正点。例如,癌症不可能发生在个体出生之前,而原发性肿瘤在确诊之前就已存在于身体中。活检及肿瘤取出时所采集的组织样本,则给我们提供了癌症演化过程中各时期的快照。这些日期能让我们推算出发生突变的速率。此外,我们还能找到放射科医生发表的关于原发性肿瘤细胞分裂速度的数据(放射科医生收集这些信息是为了估计放射疗法中杀死肿瘤细胞所需使用的辐射强度)。
我们实验室的另一位博士后研究员阿蒂拉·伊阿玛里诺利用所有这些信息,将分子演化树变成了时间树。我们第一次看到了,癌症是如何循着病人的生命轨迹演化的,还看到病人接受治疗的时间长短是如何影响癌症演化的。据此,我们可以估算致癌基因突变发生的时间。对年轻病人来说,细胞癌变通常发生在确诊之前的几年内;而对年纪较大的病人来说中,这种突变则可能发生在几十年前。
5.寻找突破口
通常,在癌症确诊的多年前(有时甚至是数十年前),让肿瘤组织有别于正常组织的第一个基因突变就已经发生了。同样令人不安的是,我们在研究中发现,90%的病人在确诊时体内就已存在至少一个转移性肿瘤细胞系。在70%的病例中,这种恶性肿瘤的分支从主干中分出来的时间,离原发性肿瘤产生的时间更近,而距离病人死亡的时间还有很远。
得到这样的结果,我们非常吃惊,因为这实在太重要了。那些后来变成转移性肿瘤的细胞,与原发性肿瘤中其他细胞的基因差异,在癌症早期(无论是就演化阶段还是时间而言)就已显现出来了。实际上,这些基因差异往往早在原发性肿瘤得以确诊前,就已经出现了。
我们本来希望找出诱发肿瘤转移性的关键基因突变,作为药物干预的作用目标,但是,因为转移性肿瘤细胞系的基因突变并无特异性,我们便把注意力从转移性肿瘤转向原始肿瘤的演化史。我们想知道,演化树的主干,也就是原发性肿瘤细胞的基因序列,是否在癌症的形成中起着特殊的作用。为了回答这一问题,我们决定弄清楚,发生在病人原发性肿瘤细胞中的基因突变,是否改变了某些与癌症相关的基因的功能。
结果确如所料。例如,著名的肿瘤抑制基因p53(抑制细胞增殖),就在很多病人的肿瘤演化早期发生了突变。原癌基因(proto-oncogene)KRAS也是这样[原癌基因一旦发生突变就会变成促使细胞不断分裂的致癌基因(oncogene)]。几乎所有的胰腺癌患者都在KRAS基因的第12位点上发生了早期突变。
这类关键基因在癌症演化树的根部频繁出现,暗示着它们在肿瘤的发生及转移过程中起着重要作用。我们推测,随着与肿瘤发生相关的突变越来越多,肿瘤发生转移的可能性就成了一个数字游戏:癌细胞数量越多,它们就有更大的概率找到便于扩散的位点,或者发生表观遗传改变,从而获得转移性。
要弄清楚这些关键基因是如何影响肿瘤的形成和转移概率,还需要进一步研究。即便如此,早期的诱发因素还是值得我们投入更多关注,因为针对它们研发的药物,可能成为癌症治疗的关键——不管是对于早期的原发性肿瘤,还是晚期癌症,都是如此。
6.清除癌症树
最新临床试验已经证实,人类有可能利用自身免疫系统来杀死癌细胞。然而,肿瘤似乎针对药物疗法和免疫疗法演化出了相应的耐受机制。癌细胞的耐受性是否像原发性肿瘤一样,源于特定的基因突变?或者像转移性肿瘤一样,受微环境和其他因素的影响?目前,我们尚不知晓答案,但是癌细胞的演化树将有助于我们弄清这一问题。
通过对时间树进行研究,我们的发现,一些不那么有名的、可能引发癌症的基因也发生了突变,但这些基因突变往往是在癌症后期发生的。也就是说,这些基因突变并不处于癌症树的主干,而处于分支位置,因此这些突变通常只出现在某些病人的肿瘤中,而在另一些病人的肿瘤中则不存在。所以,针对这类突变的疗法虽然能消灭这些分支突变,但癌症树的其他部分却会继续繁殖,危及病人的生命。我们相信,如果医生能在使用这类药物的同时,辅以杀死其他种类的癌细胞的疗法,就能事半功倍。

创意图片《呵护生命》光明图片/视觉中国
从另一方面来讲,如果一种药物针对的是一个存在于所有肿瘤的早期突变,随着含有特定新突变的癌细胞增殖,癌症可能会对该药物产生耐受性。美国耶鲁大学医学院的病理学家凯特琳娜·波利蒂及同事发现,发生在EGFR基因[另一主要的致癌(特别是肺癌)基因]上的突变,对癌症耐药性的产生起着重要作用。为了搞清楚癌症病人在接受治疗时,癌细胞为什么以及如何产生耐受性,我们的研究小组再次使用了演化生物学技术。我们构建了病人的癌症树,寻找导致耐药性肿瘤(复发性肿瘤)的基因突变。令人鼓舞的是,我们的初步研究显示,耐药性的产生似乎的确是由病人接受治疗导致的基因突变引起的。
现在,每年都会有许多新的针对特定基因突变的抗癌药物上市,传统化疗、放疗和免疫疗法相结合的复合疗法也表现出了越来越大的潜力。肿瘤学家不再将一种癌症看作是可以一概而论的疾病。而是认为,每一个病例都有其自身的特点。研究病人个体的基因组,将会对未来的癌症治疗产生巨大影响。为了更好地利用这些新工具,肿瘤学家必须成为真正的演化生物学家,只有这样,才能通过检测每位病人癌组织中的基因突变,制定有效策略,摧毁癌症树的根源和分支。
-
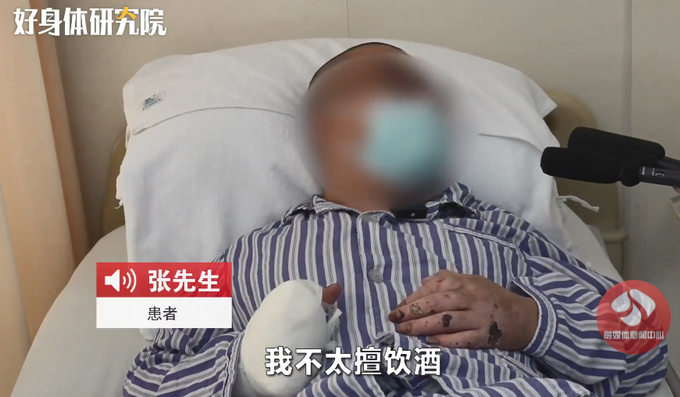
浙江杭州夫妻醉酒老公床上酣睡妻子倒挂窗外 提醒:理性饮酒安全第一
头条 22-01-21
-
美国爸爸辅导孩子写汉字气到崩溃一行字写了3小时!网友:这跟国籍无关
头条 22-01-20
-
绝望! 女子隔离14天通过监控看狗子把家拆完 网友:感到“崩溃”
头条 22-01-20
-
辽宁沈阳男子冬天醉卧路边冻掉4根手指!网友:多亏被人发现
头条 22-01-18
-
重庆一孕妇剪毁婚庆店内32件婚纱礼服当事人发文
头条 22-01-17
-
中国空间站与国际空间站一张对比图火了 网友直呼:画面引起舒适
头条 22-01-13
-
辟谣!800多人被拉定边沙漠去隔离?西安网警:假的!
头条 22-01-11
-
生日蛋糕上插满课本男孩崩溃大哭 妈妈:想提醒他好好复习
头条 22-01-11
-
男子地铁摸女性屁股被扇3分钟耳光?警方通报
头条 22-01-06
-
天津高速现驼鸟奔跑 官方回应:系车主运输途中不慎掉落已被车主领回
头条 22-01-05
-
长得挺特别!菠萝味草莓一斤150元 网友:直接买个菠萝吃不好吗
头条 22-01-05
-
“秦始皇”做核酸珍贵画面流出?逗乐网友!调侃:“秦始皇也要核酸了!”
头条 21-12-31
-
985大学硕士妈妈吐槽儿子是学渣:他爸气得2次心梗!以后只希望孩子健康成长
头条 21-12-31
-
查干湖“头鱼”拍出299.9999万的天价!网友:怎么吃才体现它的身价
头条 21-12-29
-
村主任用洒水车向摊位喷水?官方回应:责令其辞去村委会主任职务
头条 21-12-27
-
“外教辱骂防疫人员”,西安警方回应:已成立工作专班进行调查
头条 21-12-27
-
破防了!91岁奶奶和8岁猫咪的对话让人泪崩 网友:祝愿老人健康长寿
头条 21-12-23
-
5岁女童配合消防员教科书式自救 网友点赞:很勇敢!
头条 21-12-23
-
大爷被困电梯淡定唠嗑等救援 网友:为大爷的冷静沉着点赞!
头条 21-12-22
-
男子4万元存款18年后却被银行告知存款已被支取仅剩10块钱 法院:银行赔!
头条 21-12-20
-
深圳一男子加油站拔油枪点燃后逃跑 警方已介入调查纵火人员已锁定
头条 21-12-17
-
这位感动千万抖音网友的河南“留虾女孩” 入选央视年度短片《2021看见笑容》
头条 21-12-17
-
泪目!95岁妈妈病床前亲吻74岁生病的女儿 网友:孩子不管多大都是妈妈的宝贝
头条 21-12-15
-
川妹子抽中50颗榴莲直呼吃不完!网友:可以共享你的负担吗?
头条 21-12-15
-
河南省政府发布2022年元旦放假通知
头条 21-12-15
-
濮阳市聚碳新材料产业联盟成立
头条 21-12-15
-
周口机场预计什么时候建好?都有到哪些城市的航线?官方回复来了
头条 21-12-15
-
预计明年超50家企业回归,瑞银称中概股H股上市将继续升温
头条 21-12-15
-
新乡发现一境外输入奥密克戎病例密接者,活动轨迹公布
头条 21-12-15
-
河南:中药配方颗粒不得在医疗机构以外销售
头条 21-12-15
-
中原环保完成发行5亿元超短融,利率2.95%
头条 21-12-15
-
南阳市政府将与中车四方所在新能源装备等领域开展深入合作
头条 21-12-15
-
郑州出台新措施:公租房可“掌上”缴租秒办理
头条 21-12-15
-
国家统计局:11月社会消费品零售总额增长3.9%
头条 21-12-15
-
中国11月规上工业增加值同比增长3.8%
头条 21-12-15
-
1207万!全年就业超额完成预期目标
头条 21-12-15
-
河南凯旺科技公开发行2396万股新股,获6321.47倍申购
头条 21-12-15
-
事关货币政策、房地产、全面注册制,一行两会划定明年工作重点
头条 21-12-15
-
隔夜欧美·12月15日
头条 21-12-15
-
多部委密集部署明年工作!三大看点值得关注
头条 21-12-15
-
立方风控鸟·早报(12月15日)
头条 21-12-15
-
医药巨头今日登陆科创板!高瓴重仓"陪伴",引入"绿鞋"机制
头条 21-12-15
-
皮海洲:临门一脚踏刹车!龙竹科技终止转板说明了什么
头条 21-12-15
-
立方风控鸟·晚报(12月14日)
头条 21-12-14
-
成渝地区双城经济圈建设2022年拟推进160个重大项目,投资约2万亿元
头条 21-12-14
-
总投资额超百亿!中建七局接连中标两个EPC总承包项目
头条 21-12-14
-
2022年部分地方债提前下达,财政提前发力稳经济
头条 21-12-14
-
信阳华信投资集团10亿元中票完成发行,利率3.70%
头条 21-12-14
-
新强联拟择机出售所持明阳智能股票
头条 21-12-14
-
洛阳新强联拟亿元入股山东拟IPO公司,持股4.50%
头条 21-12-14
-
焦作在这场推介会上现场签约28个项目,总投资240亿元
头条 21-12-14
-
河南7种轻微交通违法可免罚
头条 21-12-14
-
广州高校发现古墓考古专业出动!网友:这不巧了嘛!毕业论文自己找来了
头条 21-12-14
-
浙江乐清民警自曝37岁未婚救下轻生女子 网友:一定要最爱自己
头条 21-12-14
-
画面感太强!主人出差猫咪打开水龙头把家淹了 网友:当然是原谅它
头条 21-12-09
- 加盟大平台,继往又开来!怡亚通全球招募合2022-01-25
- 伊利新春迷你剧《我耀我家》:关于春节和冬2022-01-25
- 360金融课堂学员:误入杀猪盘后的重生与成长2022-01-25
- 2021年全国海关查扣进出口侵权嫌疑货物7.92022-01-25
- 相约冰雪,一起来丨逐梦前行2022-01-25
- 国家卫健委:昨日新增确诊病例45例 其中本2022-01-25
- 相约冰雪,一起来|以中国速度完成冰雪运动2022-01-25
- 超全科普!一次看懂北京冬奥15个比赛项目2022-01-25
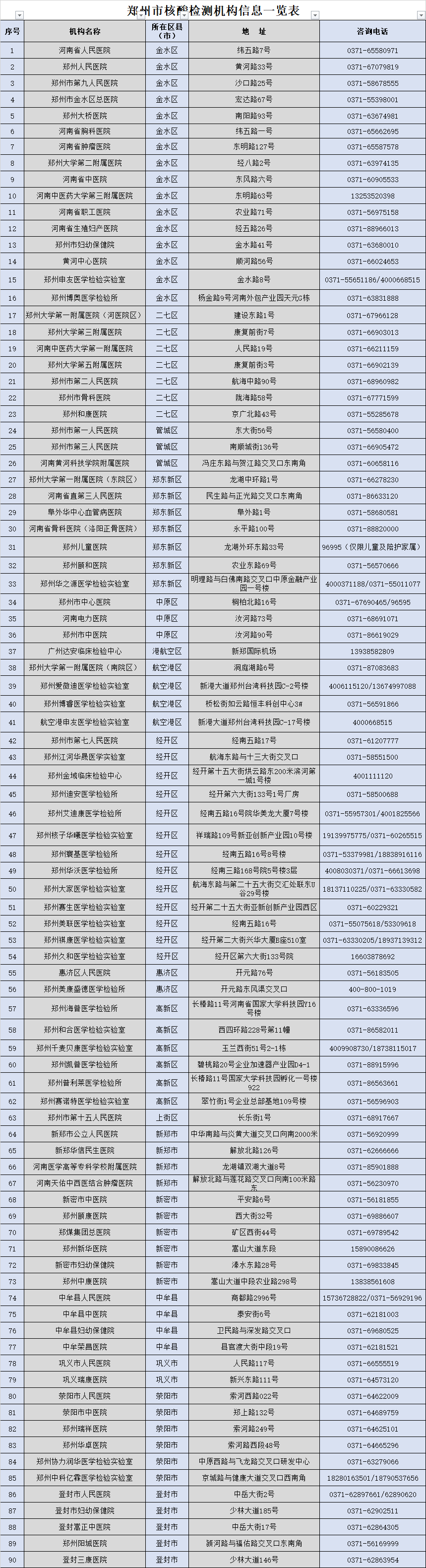
- 本次疫情郑州共开展了十轮全员核酸检测 共2022-01-25
- 噪声污染防治法将于2022年6月5日施行2022-01-25
- 扩散!疫情期间血透预约平台在郑好办App上2022-01-25
- 速看!三门峡:返乡人员隔离管控措施汇总2022-01-25
- 官方回应:关于禹州市一高一学生反映不能返2022-01-25
- 今年将建30家河南省科普基地 提升广大公众2022-01-25
- 春节前郑州有望全域“低风险” 1月25日起2022-01-25
- 周口郑州新生儿登记排全国前十 王李张等222022-01-25
- 洛阳全面深入推动县管校聘改革 800多所中2022-01-25
- 2022年度一次性工亡补助金标准确定 调整为2022-01-25
- 请乘坐合规车辆!这些网约车非法营运被查处2022-01-25
- 河南:26至28日多地仍有大到暴雪局部暴雪2022-01-25
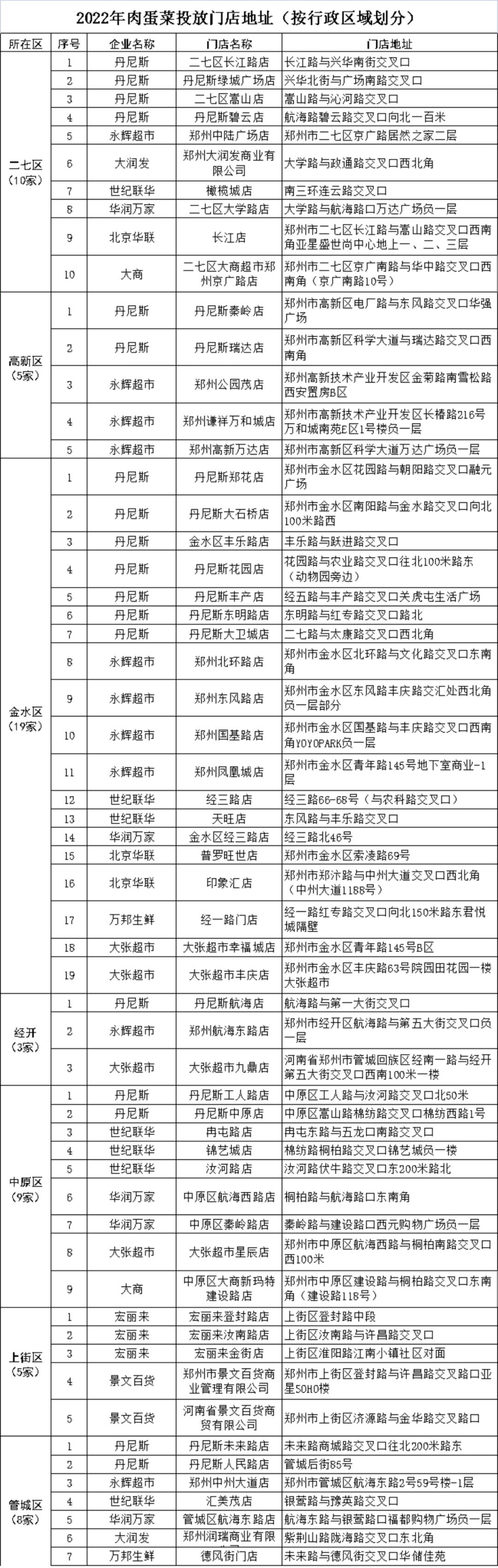
- 郑州市政府投放储备肉蛋菜 市民购买热情高2022-01-25
- 春节即将来临 郑州市全面禁售禁放烟花爆竹2022-01-25
- 郑州发布2022年32号通告:部分区域疫情风险2022-01-25
- 河南出台“十四五”期间系列养老服务体系“2022-01-25
- 春节前河南将出现一轮长时间大范围的中度至2022-01-25
- 郑州预计除夕前全域降为低风险 春运期间人2022-01-25
- 郑州行程卡何时摘星?调整风险等级及区域解2022-01-25
- 春运期间人员返郑离郑防控政策来了 返郑人2022-01-25
- 郑州发布31号通告:9个城区开展新冠病毒核2022-01-25
- 郑州已解除封控管控隔离群众 可根据病情需2022-01-25