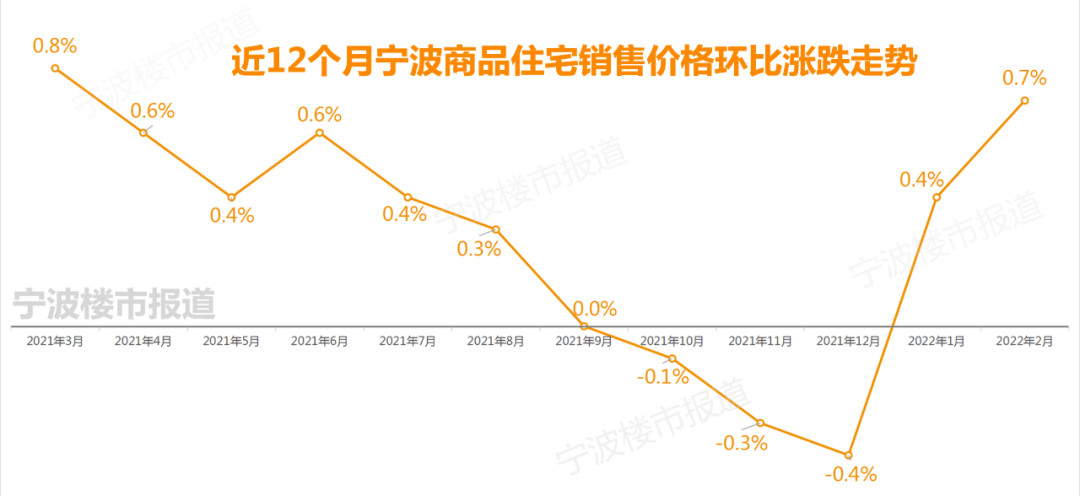
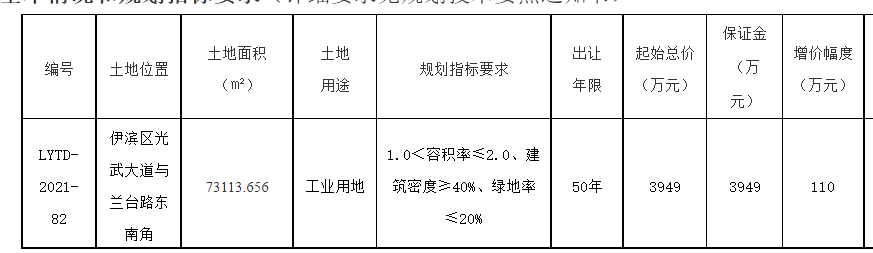
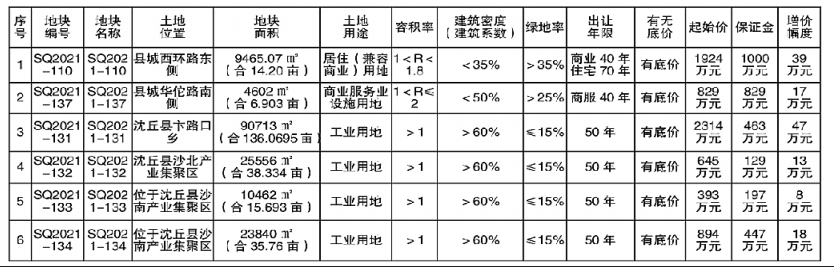
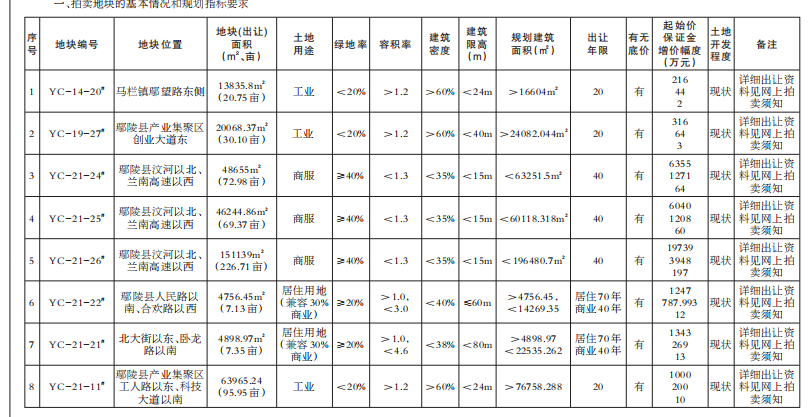
他们的发现将于3月18日发表在《科学》杂志上,最终可能导致开发出将甲烷气体转化为甲醇的人造生物催化剂。
论文的资深作者、西北大学的Amy Rosenzweig说:“甲烷有很强的结合力,所以有一种酶可以做到这一点,这非常了不起。如果我们不确切了解该酶是如何进行这种困难的化学反应的,我们就无法为生物技术应用设计和优化它。”
Rosenzweig是西北大学温伯格文理学院生命科学的Weinberg Family特聘教授,她在分子生物科学和化学领域都有任职。
这种被称为颗粒甲烷单加氧酶(pMMO)的酶是一种特别难以研究的蛋白质,因为它被嵌入了细菌的细胞膜中。
通常情况下,当研究人员研究这些甲烷细菌时,他们使用一种严格的程序,即用一种洗涤剂溶液将蛋白质从细胞膜上撕下来。虽然这个过程有效地隔离了酶,但它也杀死了所有的酶的活性,并限制了研究人员能够收集多少信息--就像监测一个没有心跳的心脏。
在这项研究中,该团队完全使用了一种新的技术。Christopher Koo是第一作者,也是Rosenzweig实验室的博士生,他想知道通过将酶放回类似于其原生环境的膜中,他们是否能学到一些新东西。Koo利用来自细菌的脂质在一个被称为纳米盘的保护性颗粒内形成一个膜,然后将酶嵌入该膜中。
Koo说:“通过在纳米盘内重新创造酶的本地环境,我们能够恢复酶的活性。然后,我们能够使用结构技术在原子水平上确定脂质双分子层是如何恢复活性的。在这样做的过程中,我们发现了酶中可能发生甲烷氧化的铜位点的完整排列。”
研究人员使用了低温电子显微镜(cryo-EM),这是一种非常适合膜蛋白的技术,因为在整个实验过程中,脂质膜环境没有受到干扰。这使他们能够首次高分辨率地观察到活性酶的原子结构。
Rosenzweig说:“作为最近低温电子显微镜‘分辨率革命’的结果,我们能够看到原子级的结构细节。我们所看到的完全改变了我们对这种酶的活性部位的思考方式。”
Rosenzweig表示,低温电子显微镜结构为回答继续堆积的问题提供了一个新的起点。甲烷是如何进入酶的活性部位的?或者甲醇是如何走出酶的?活性部位的铜是如何进行化学反应的?接下来,研究小组计划使用一种称为低温电子断层扫描(cryo-ET)的前沿成像技术直接在细菌细胞内研究该酶。
如果成功的话,研究人员将能够准确地看到该酶在细胞膜中的排列方式,确定它在真正的本地环境中如何运作,并了解该酶周围的其他蛋白质是否与它相互作用。这些发现将为工程师提供一个关键的缺失环节。
Rosenzweig说:“如果你想优化这种酶,把它插入生物制造途径或消耗甲烷以外的污染物,那么我们需要知道它在本地环境中是什么样子,以及甲烷在哪里结合。你可以用带有工程酶的细菌从压裂现场采集甲烷,或者清理石油泄漏。”
-
河南自贸区郑州片区法院发通告:倡导开展网上诉讼
头条 22-03-23
-
新乡中新商业保理获批设立,注册资本1亿元
头条 22-03-23
-
国家发改委发布氢能产业规划:探索设立制氢基地、鼓励氢能企业上市
头条 22-03-23
-
国家卫健委:昨日本土新增“2591+2346”
头条 22-03-23
-
比亚迪在深圳成立融资租赁公司,注册资本10亿元
头条 22-03-23
-
深交所:中兴通讯拟披露重大事项,今日开市起临时停牌
头条 22-03-23
-
理想汽车:4月1日起 理想ONE售价上调至34.98万元
头条 22-03-23
-
旗下第6家上市公司登陆创业板,新希望刘永好的资本版图里都有谁?
头条 22-03-23
-
河南昨日新增本土确诊病例6例
头条 22-03-23
-
通达股份拟中标国家电网1.93亿元采购
头条 22-03-23
-
巴奴总部迁至北京,捞王、七欣天谋求上市,“火锅第三股”之争,将花落谁家?
头条 22-03-23
-
隔夜欧美·3月23日
头条 22-03-23
-
立方风控鸟·早报(3月23日)
头条 22-03-23
-
3月22日0时至20时,焦作新增本土无症状感染者4例
头条 22-03-22
-
个转企、小升规、规改股、股上市、企转新 洛阳最新支持政策来了!
头条 22-03-22
-
宝能集团董事长姚振华:已领取法律文书,公司欠了银行利息
头条 22-03-22
-
广西:做好抵梧旅客家属的接待衔接
头条 22-03-22
-
民航局:将尽快搜寻黑匣子并开展数据分析
头条 22-03-22
-
目前对东航客机坠毁事故原因尚无清晰判断 将全力搜集各方证据
头条 22-03-22
-
东航:飞机起飞前符合适航要求 已联系到全部旅客家属
头条 22-03-22
-
东航:开展“一户一册一专班”的援助服务
头条 22-03-22
-
中原内配为子公司1402万元融资租赁(售后回租)业务提供担保
头条 22-03-22
-
蓝天燃气2021年度净利润升26.45%至4.21亿元 拟10派5元
头条 22-03-22
-
蓝天燃气拟为两家全资子公司提供3.3亿元担保
头条 22-03-22
-
立方风控鸟·晚报(3月22日)
头条 22-03-22
-
直面商业化的钉钉:不仅探索还要快速商业化
头条 22-03-22
-
桂林消防救援支队今日下午已开展失事客机黑匣子搜寻工作
头条 22-03-22
-
阿里、京东、拼多多:努力活成“友商”的样子
头条 22-03-22
-
同程旅行2021年营收75.4亿元,同比增长27.1%
头条 22-03-22
-
总投资50亿元,漯河一高端手机精密部件生产基地项目签约
头条 22-03-22
-
河南太康新增3例阳性,详情公布
头条 22-03-22
-
通道业务规模压降近8万亿 信托业本轮调整或将见底
头条 22-03-22
-
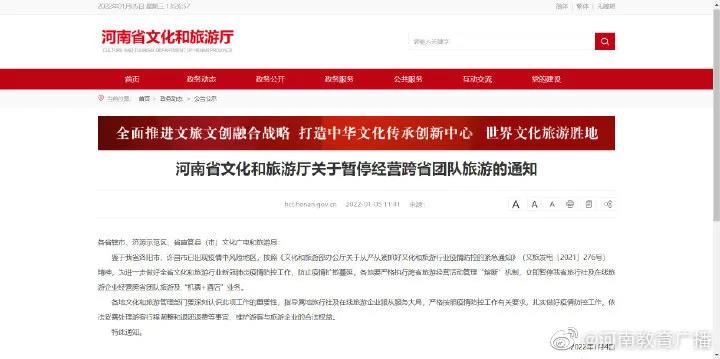
焦作最新通告:人员限制流动!车辆限制流动!暂停堂食
头条 22-03-22
-
南阳今年实施公共停车场建设工程,新增车位5000个
头条 22-03-22
-
河南省财政下达9.7亿元专项资金支持林业发展
头条 22-03-22
-
河南能源:郑州农商银行15亿元中长期贷款落地
头条 22-03-22
-
财政部:2022年2月全国发行新增债券4939亿元
头条 22-03-22
-
检察机关依法分别对王文生、林洪、任晓冬、陆世成提起公诉
头条 22-03-22
-
即日起,焦作市中小学校暂停线下教学
头条 22-03-22
-
国家医保局同意河南、重庆提出的新冠病毒抗原检测服务收费方式
头条 22-03-22
-
疫情什么时候结束?国家卫健委专家:需要这四个条件
头条 22-03-22
-
郑州48号通告:对部分区域实行分类管理
头条 22-03-22
-
突然爆雷!“万门大学”跑路了
头条 22-03-22
-
洛阳一产业集群成功中标2021年国家先进制造业集群
头条 22-03-22
-
罗永浩:债务还完会官宣,新的创业项目是AR
头条 22-03-22
-
关于郑州市新增1例新冠肺炎确诊病例情况的通报
头条 22-03-22
-
鼎龙文化澄清传言 确认财务总监搭乘失事飞机
头条 22-03-22
-
助力全民抗疫,腾讯健康全套抗疫工具箱免费开放接入
头条 22-03-22
-
泰康人寿启动八项理赔服务举措,快速应对东航坠机事故
头条 22-03-22
-
中原证券成功保荐“何氏眼科”在创业板挂牌上市
头条 22-03-22
-
今12时起,焦作多地划定为中风险地区
头条 22-03-22
-
商丘新任命一批干部:龚学超任睢县人民政府副县长、代理县长
头条 22-03-22
-
河南第二批省实验室正式揭牌!龙湖现代免疫实验室可研究新冠等四类超级疫苗
头条 22-03-22
-
河南第二批省实验室正式揭牌!龙门实验室要为制造业打造更强关节
头条 22-03-22
-
河南第二批省实验室正式揭牌 中原关键金属实验室要让小金属发挥大作用
头条 22-03-22
- 研究:嗜甲烷细菌有望将强大的温室气体转化2022-03-23
- 科学家创造出理想的披萨面团:无需酵母就能2022-03-23
- 中兴通讯:停牌事项与美国法院召开关于缓刑2022-03-23
- 甘肃省新增本土确诊病例6例 新增本土无症2022-03-23
- 出行注意!西安火车站进出站政策有调整2022-03-23
- 国家网信办就弹窗信息征求意见 弹窗2022-03-23
- 海口:个人购买新冠病毒抗原检测试剂需实名2022-03-23
- 一图读懂 | 氢能产业发展中长期规划(2022022-03-23
- 北京今明两天连升温,春天来了么?气象部门2022-03-23
- 河南太康连发通告 要求车辆限行、人员静止2022-03-23
- 沪强深弱热点有所转向 炒作降温转为防守为2022-03-23
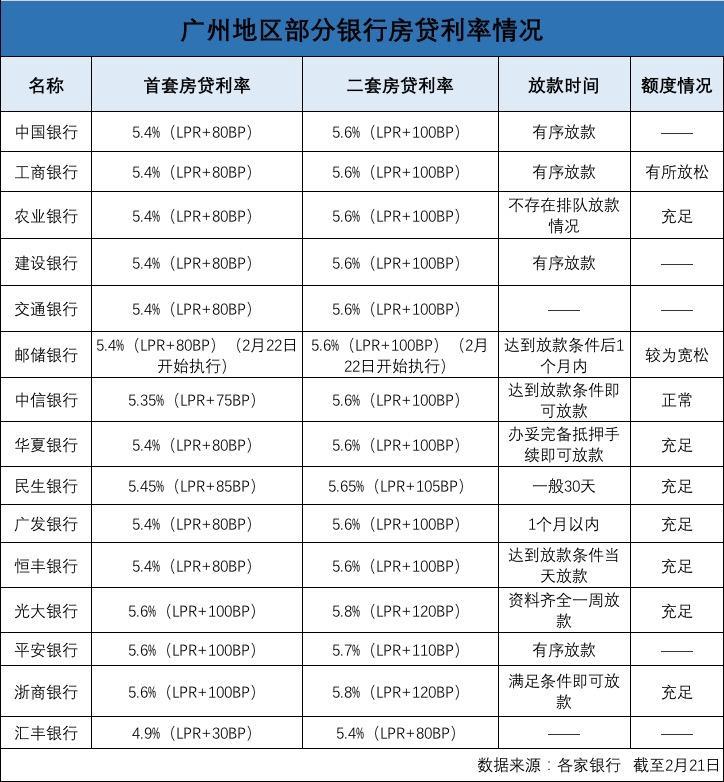
- 投资一直亏 房贷利率逐步下调手里的钱提前2022-03-23
- 供应缺口加大 铝价持续上涨盘中大涨5%2022-03-23
- 原油供应存忧 国际油价大幅上涨超7%2022-03-23
- 波音公司股价显著下跌 业绩前景也将受近年2022-03-23
- 美联储或更激进加息抑制国内通胀 美就业市2022-03-23
- 欧洲多国愈发倚重核电 调整政策加大核电应2022-03-23
- 全球6G竞赛全面拉开帷幕 产业链相关巨头抢2022-03-23
- 恒生指数高开高走收涨3.15% 南向资金年内2022-03-23
- 隆基股份最新披露百亿采购大单 光伏龙头锁2022-03-23
- 北交所上市公司年内获机构密集调研2022-03-23
- 新一轮基金自购潮再度浮现 多家基金看好A2022-03-23
- 储能产业迎重磅利好 产业链日渐成熟上市公2022-03-23
- 日本银发产业喜中有忧 银发技术及银发产业2022-03-23
- 专项债“杠杆”撬动万亿基建投资 分地区限2022-03-23
- 【观点】设立金融稳定保障基金织牢金融安全2022-03-23
- “十四五”能源规划敲定重点 到2025年非化2022-03-23
- 国家级都市圈再扩围区域一体化发展提速 多2022-03-23
- 芦淞区建立“专精特新”企业培育库 培育“2022-03-23
- 高速逆行,韶关交警 “秒”出警!2022-03-23